前沿研究
应用自动免疫磁分离和酶比色法检测大肠杆菌O157:H7
-
来源:
海南微氪生物科技股份有限公司
日期:2023-10-26 16:42:02
点击:393
属于:前沿研究
- 目前,应用于食品工业的食源性细菌检测技术都存在费时费力的问题。Ji Young 、 Kisang等开发了一种自动免疫磁分离结合比色法,用于快速检测食品样品中大肠杆菌O157:H7。
肠出血性大肠杆菌O157:H7 (E. coli O157:H7)是主要的食源性病原体之一,主要通过受污染的食物和水传播。目前,一种新兴大肠杆菌检测方法使用氯酚红β-半乳糖苷(CPRG)等着色剂作为大肠杆菌β-半乳糖苷酶(β-GAL)的底物,发生反应出现颜色变化,以此鉴定大肠杆菌。然而,该方法还需要消除食品样品中的着色剂,以清晰地分析比色响应。而免疫磁分离(IMS)可选择性地从异质基质中分离目标分子,减少食品基质效应。
该研究提出了一种自动化IMS系统结合酶比色法快速检测食品样品中的致病性大肠杆菌O157:H7的方法。如图1所示,经过预富集和目标特异性免疫磁珠捕获反应后,在自动IMS过程中有效分离和浓缩目标细菌。然后通过将收集的细菌适当裂解,CPRG(黄色)与释放的β-GAL反应变成CPR(品红色)。由此产生的颜色变化与牛奶样品中细菌的浓度有关,细菌的数量可以通过吸光度测量或肉眼观测。
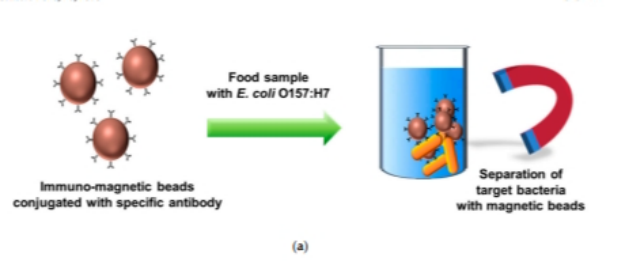


注:(a)免疫磁分离(IMS)法从样品中分离和浓缩目标细菌的基本原理;(b) b - per酶解目标菌后,β-GAL酶基将氯酚红β半乳糖苷(CPRG)转化为CPR的比色响应;(c)采用自动化IMS系统结合比色反应分析的检测方法。
图2显示了自动化IMS系统中细菌回收组件的整个过程。首先,注射带有免疫磁珠的预富集乳糖(100 mL),并通过蠕动泵连续流动150 mL含0.05% Tween-20的BPW(图2a)。下一步,利用覆盖在磁棒上的玻璃圆筒将样品中的磁珠分离(图2b、c)。磁珠分离完成后,将免疫磁珠自动浓缩到含有2ml PBS缓冲液的回收管中(图2d、e)。该过程重复两次,以收集样品溶液中剩余的免疫磁珠。最后在自动化IMS过程中自动分离和浓缩目标细菌。

 图2 自动化IMS过程的代表性逐步图像
图2 自动化IMS过程的代表性逐步图像为了最大限度地提高酶促β-GAL反应对CPRG的比色变化,以相同浓度的大肠杆菌O157:H7培养物对β-GAL源,CPRG浓度、酶促反应时间、样品反应体积、裂解条件等实验反应参数进行优化。结果显示,选择浓度为1.5 mM的CRPG作为着色剂源,0.1 mL的B-PER溶液作为最佳反应体积,80%的B-PER溶液作为裂解条件提取β-GAL酶。
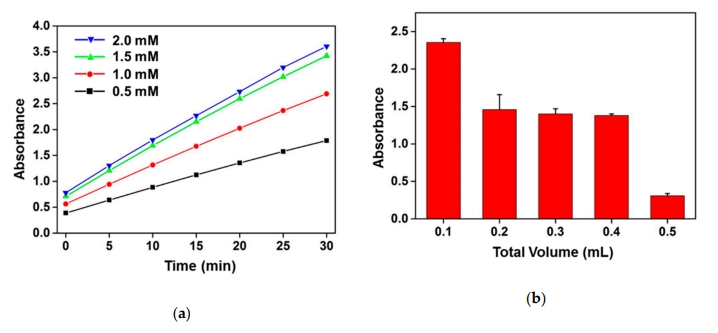 图3 优化酶促比色反应变化反应对目标菌的灵敏检测
图3 优化酶促比色反应变化反应对目标菌的灵敏检测 注:(a)与相同浓度的大肠杆菌O157:H7裂解物的CPRG浓度反应的比色响应取决于反应时间(最长30 min);(b)相同量的CPRG和大肠杆菌O157:H7裂解物在0.1-0.5 mL的不同总反应体积下,反应30 min后的吸光反应情况。
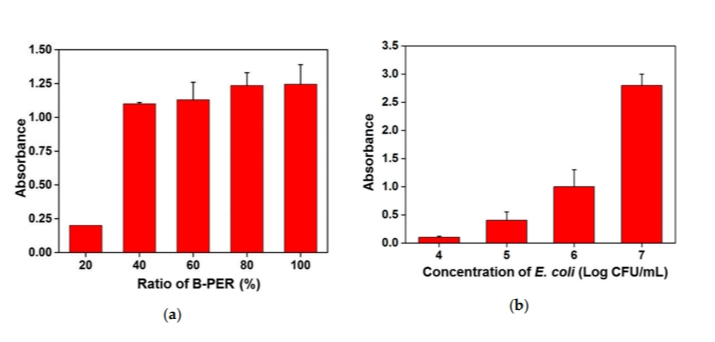
图4 优化酶促比色变化反应对目标细菌的灵敏检测
注:(a) B-PER与5 mM PBS混合比例对目标细菌裂解的比色响应;(b)优化实验条件下目标菌在104 ~ 107 CFU/mL范围内的吸光度比较。
按照上述最佳条件,酶促反应完成30 min后,测定不同浓度大肠杆菌O157:H7中CPRG转化为CPR的吸光度。如图4b所示,酶反应比色法鉴定大肠杆菌O157:H7存在时,裂解步骤的目标菌浓度应大于105 CFU/mL。
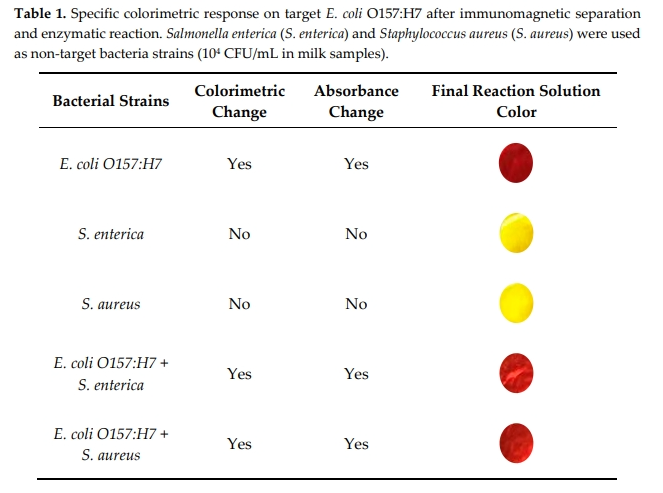
为了确认对目标细菌的特异性比色反应,使用非目标细菌如肠沙门氏菌(S. enterica)和金黄色葡萄球菌(S. aureus)对上述检测方法进行了评估。结果表明,非目标细菌没有中断特异性酶促反应,不会被识别为大肠杆菌。
表1 免疫磁分离和酶促反应对目标大肠杆菌O157:H7的特异性比色反应。
以肠道沙门氏菌(S. enterica)和金黄色葡萄球菌(S. aureus)作为非靶菌菌株(牛奶样品中104 CFU/mL)
此项研究建立了一种简便、快速的大肠杆菌O157:H7检测方法,将自动化IMS系统和酶基比色法相结合,优点在于可以在相同的工作时间内浓缩食品样品中的目标细菌并提高比色响应,并且有效分离食品样品中的目标细菌。最终达到通过吸光度测量的数值定量地检测目标细菌,通过颜色变化信息定性地检测目标细菌。

