前沿研究
检测食源性病原体的微流控传感器装置
-
来源:
海南微氪生物科技股份有限公司
日期:2023-11-18 21:08:52
点击:342
属于:前沿研究
- 食源性病原体污染是全世界主要的公共卫生问题,Sandeep B. Somvanshi团队开发了一种新型纸基单输入通道微流体装置,可以同时检测多种食源性细菌,并且通过图像分析对比色信号进行读取和定量化,同时测量细菌浓度,使该微流控装置实现定量化检测。
近年来,核酸适体作为一类新型单链寡核苷酸出现,在病原生物传感和诊断技术研究中引起了极大的兴趣。实验室通过指数富集(SELEX)方法,多轮扩增分离出具有优越亲和力的目标结合适体,这些靶向适配体识别并特异性地附着所需的目标。
纸基生物分析设备(PBD)作为食品安全和生态监测的潜在候选设备,与其他生物传感器相比,具有操作简单,多功能性,成本效益,便携性,制造简单,兼容性和易于一次性使用的优点。将PBD与比色技术相结合,实现肉眼可视化病原体检测。此外,添加简单的图像分析技术可以提供半定量分析。采用标准光学技术,如数码相机或纸质扫描仪,再加上图像处理软件,可以进一步对结果进行量化。
该实验设计和开发了核酸适配体修饰的纳米级金颗粒(AuNPs),再将此AuNPs修饰在聚苯乙烯微粒(PS)上,用于大肠杆菌O157:H7和鼠伤寒沙门氏菌的纸基多重检测,以及比色信号的定量。AuNPs修饰的PS微粒(PS - Au)结合盐基聚集机制可以提高比色信号灵敏度。
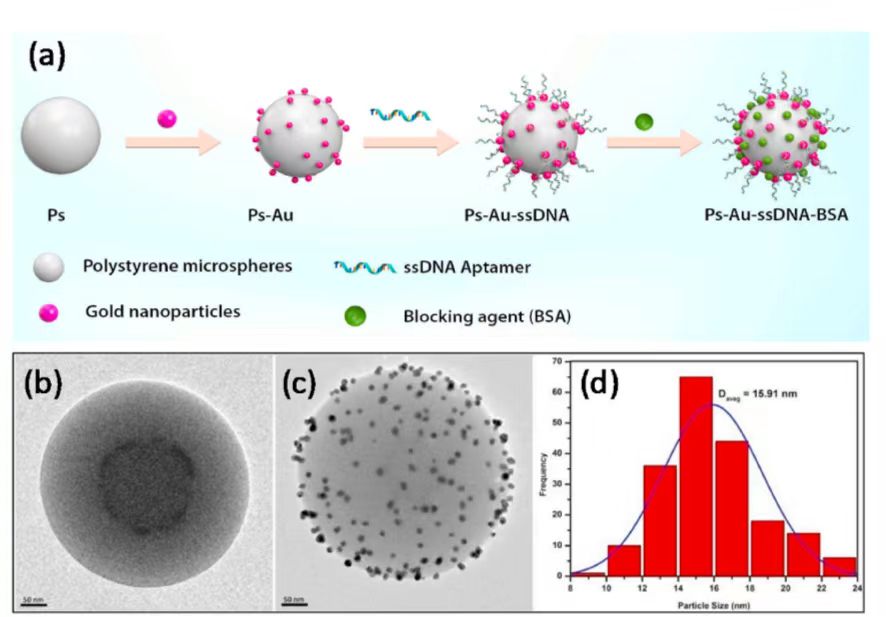
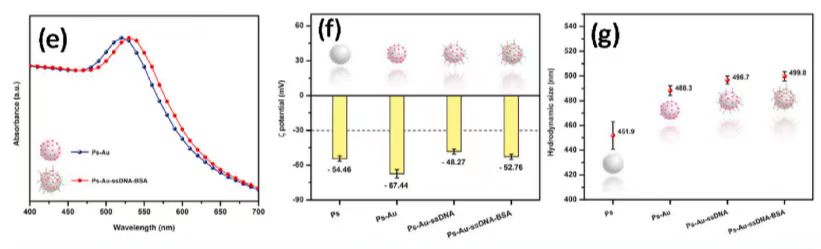
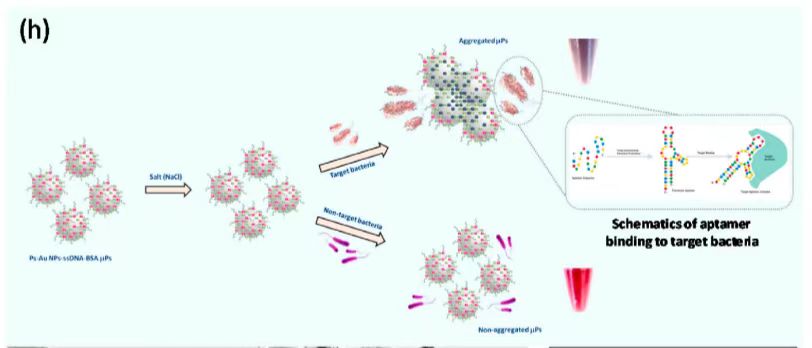
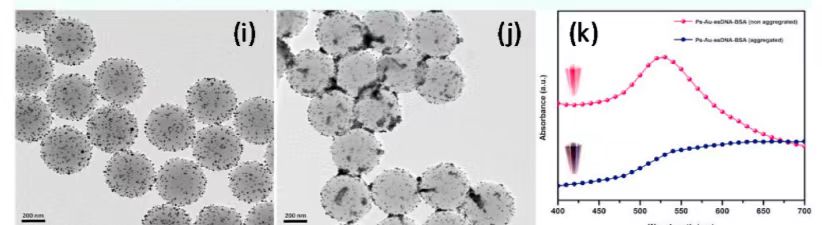
图1 (a)PS-Au-ssDNA-BSA微粒设计 (b)、(c) PS、PS-Au微粒TEM图像 (d)AuNPs粒径分布图(e)PS-Au和 PS-Au-ssDNA-BSA微粒紫外可见光谱 (f)PS、PS-Au、PS-Au-ssDNA 、PS-Au-ssDNA-BSA微粒的ζ电位 (g)流体动力学尺寸(h)检测机制的示意图 (i)非聚合PS-Au-ssDNA-BSA微粒(j)聚合PS-Au-ssDNA-BSA微粒的TEM图像 (k)非聚集和聚集PS-Au-ssDNA-BSA微粒的紫外可见光谱。
采用柠檬酸还原法合成修饰聚苯乙烯(PS)的金纳米粒子(AuNPs),通过观察溶液的粉红色来证实成功制备了AuNPs修饰的PS微粒(PS-AuNPs)。靶特异性适配体通过静电相互作用在PS-AuNPs微粒子上实现功能化。基于溶液的比色检测中,由于金纳米粒子的光谱特性,A650/ A530比值越高,聚合物越多。因此,选择吸光度比A650/A530。检测区的比色信号由光学系统捕获。
在PS上修饰AuNPs增强了AuNPs的稳定性,提高了生物传感器的灵敏度和选择性。Zeta (ζ)电位测量是为了了解微粒的表面电荷和胶体稳定性随制造过程的变化。在PS微粒上修饰AuNPs后负ζ电位增加,这是由于带负电荷的柠檬酸离子出现在AuNPs表面,从而稳定了颗粒。
用于检测的适配体修饰比色微粒的控制聚集对于实现高灵敏度和信号增强至关重要。用适配体修饰AuNPs提高了胶体稳定性,并保护其免受盐诱导的聚集。在适配体修饰前后,向微颗粒中加入不同浓度(10 mM - 100 mM)的氯化钠(NaCl),结果显示进一步的检测实验以NaCl盐浓度为50 mM进行优化。优化细胞结合孵育时间为5 min,温度为25℃。
在优化NaCl浓度(50 mM)下,适配体与目标菌结合并从AuNPs表面解吸导致AuNPs的聚集,溶液发生比色变化(从粉红色到紫色)。在非目标细菌存在和优化的NaCl浓度(50 mM)下,适配体不与非靶标细菌结合,保留在AuNPs表面,不会造成AuNPs聚集,颜色保持粉红色。图1h也显示了靶标相互作用的示意图,适配体序列的一级结构形成三维结构,然后与目标细菌的表面受体结合。
图2a、d分别为大肠杆菌O157:H7和鼠伤寒沙门氏菌的溶液比色法检测和优化结果。适配体EC-1对大肠杆菌O157:H7更为敏感,适配体ST-2则更适合于鼠伤寒沙门氏菌。图2b,e为所有适配体的吸光度比(A650/A530)与大肠杆菌O157:H7和鼠伤寒沙门氏菌对数浓度的关系图,EC-1适配体的A650/A530与不同浓度的大肠杆菌O157:H7的相关性(图2b)表现出较好的线性关系,尤其在103CFU/mL-108 CFU/mL的浓度范围内,ST-2适配体的A650/A530与不同浓度鼠伤寒沙门氏菌的相关性(图2e)表现出较好的线性关系。图2g,j显示了高浓度(108 CFU/mL)靶菌和非靶菌对大肠杆菌O157:H7和鼠伤寒沙门氏菌特异性适配体EC-1和ST-2的吸光比(A650/A530)。靶菌颜色的显著变化说明适配体EC-1和ST-2对靶菌具有较高的亲和力,而其他非靶菌不能与适配体结合,这表明适体EC-1和ST-2对靶菌具有高度特异性。

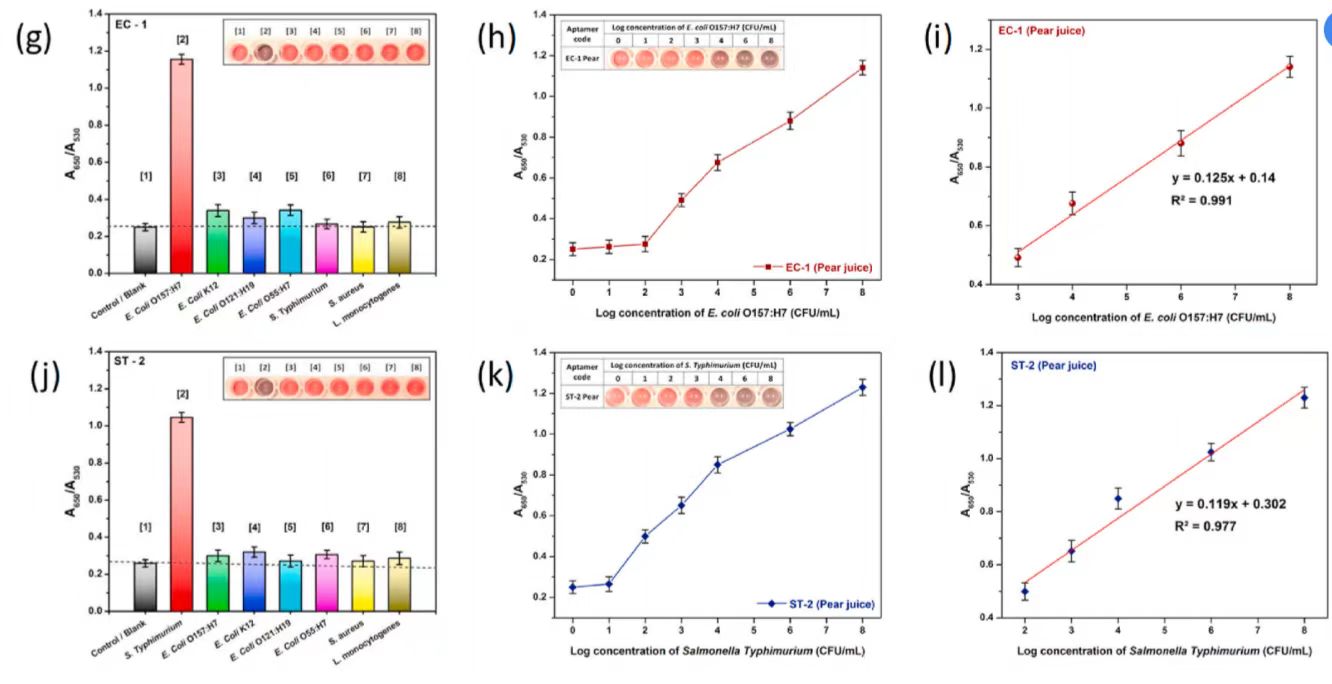
图 2(a)大肠杆菌O157:H7适体的比色检测与优化 (b)大肠杆菌O157:H7吸光度比(A650/A530)与对数浓度图 (c) EC-1适体的校准曲线 (d)鼠伤寒沙门氏菌的比色检测与优化 (e)鼠伤寒沙门氏菌吸光度比(A650/A530)与鼠伤寒沙门氏菌对数浓度图 (f) ST-2适体校准曲线,(g) EC-1特异性图,(h)梨汁中大肠杆菌O157:H7的比色检测和吸光度(A650/A530)与对数浓度图 (i)梨汁中EC-1的校准曲线 (j) ST-2的特异性图 (k)梨汁中鼠伤寒沙门氏菌的比色检测和吸光度(A650/A530)与对数浓度图 (l)梨汁中ST-2的校准曲线
采用溶液法对梨汁样品中的大肠杆菌O157:H7和鼠伤寒沙门氏菌进行了检测,以确定所提出的比色传感器在食品基质中的适用性。图2h,k显示了适体EC-1和ST-2在梨汁样品中的比色响应。由图2h可以看出,适体EC-1在梨汁中浓度为103CFU/mL-108 CFU/mL范围内表现出良好的线性响应。
为了将细菌检测从溶液转化为基于多路微流控纸的适体传感器装置,采用蜡染技术制作了纸质装置。通过四步校准优化微流控纸装置设计,如图3a所示
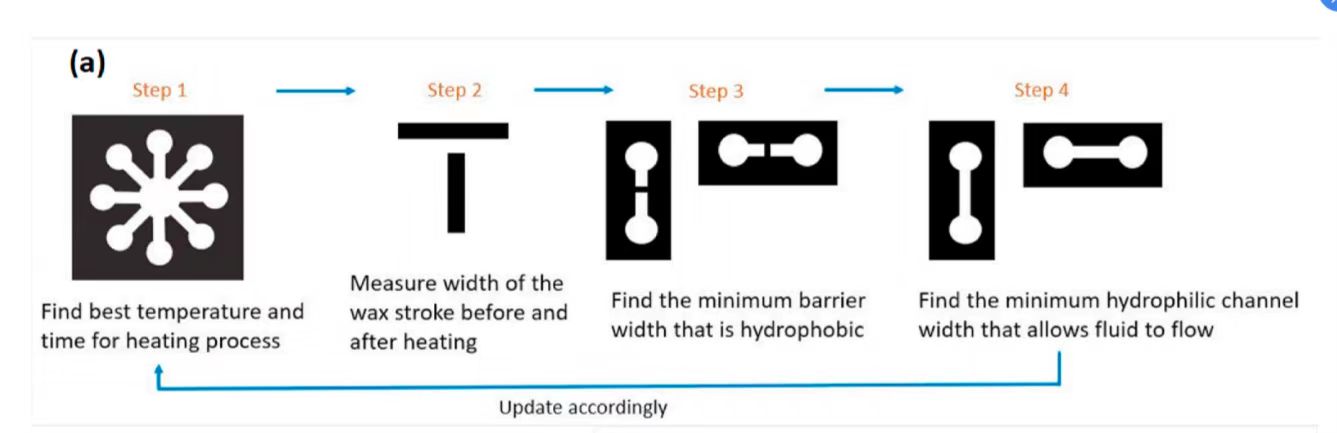
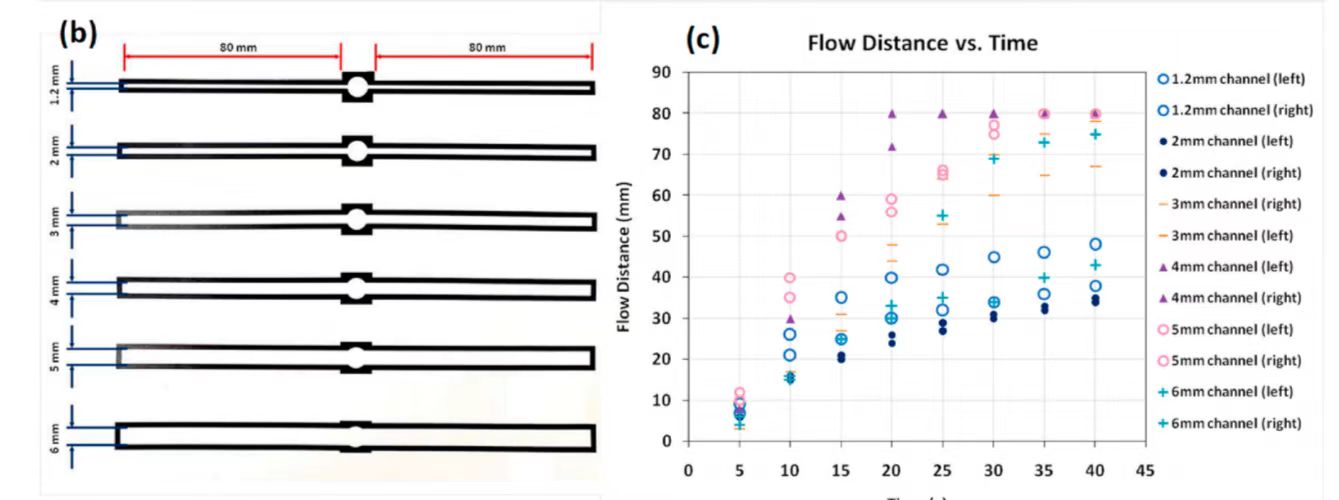
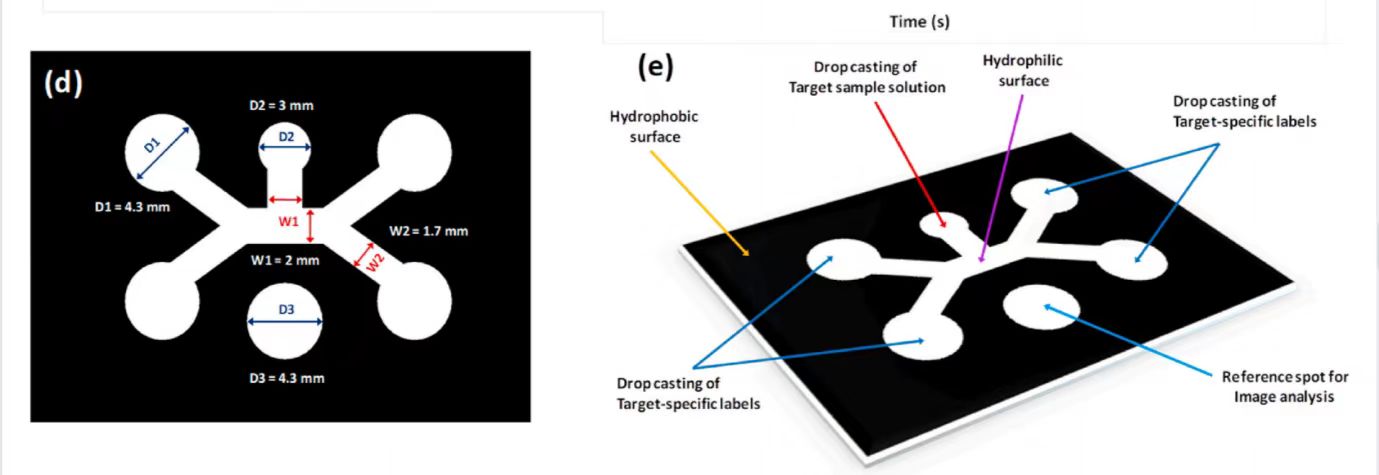
图 3(a)蜡印工艺优化实验流程图 (b)不同宽度蜡内通道流量优化图 (c)增加通道宽度流量随时间变化图 (d-e)制纸装置优化设计图
图4a显示了不同浓度大肠杆菌O157:H7的纸基比色检测响应。随着大肠杆菌O157:H7浓度的增加,颜色由深粉色变为灰色,再变为浅紫色。考虑到每种浓度的样品数量和检测外观,将图像重新排列为三类:类别1(0,101,102 CFU/mL)类别2(103,104 CFU/mL)类别3(106,10 CFU/mL)。通过4重交叉验证对线性核支持向量机算法(SVM)的性能进行评价。计算出分类性能对类别1、类别2和类别3的平均准确率分别为92.9%、100%和87.5%。图4d显示了不同浓度鼠伤寒沙门氏菌的纸基比色检测响应,随着鼠伤寒沙门氏菌浓度的增加,制纸装置的颜色由深粉色变为灰色,再变为浅紫色,如图4e所示,采用适配体(ST-2)的微流控适体传感器装置可在低至102 CFU/mL的条件下成功检测鼠伤寒沙门氏菌的存在。在基于溶液的检测中,适配体修饰的粒子与每一个靶标都有积极的相互作用,并且不受任何阻碍地结合靶标。然而,在基于纸张的检测中,每个目标都不能与适配体修饰的粒子积极地相互作用,这影响了线性响应。该实验所涉及设计的纸基设备通过提供了实际的测试条仍然平衡了这一缺点。
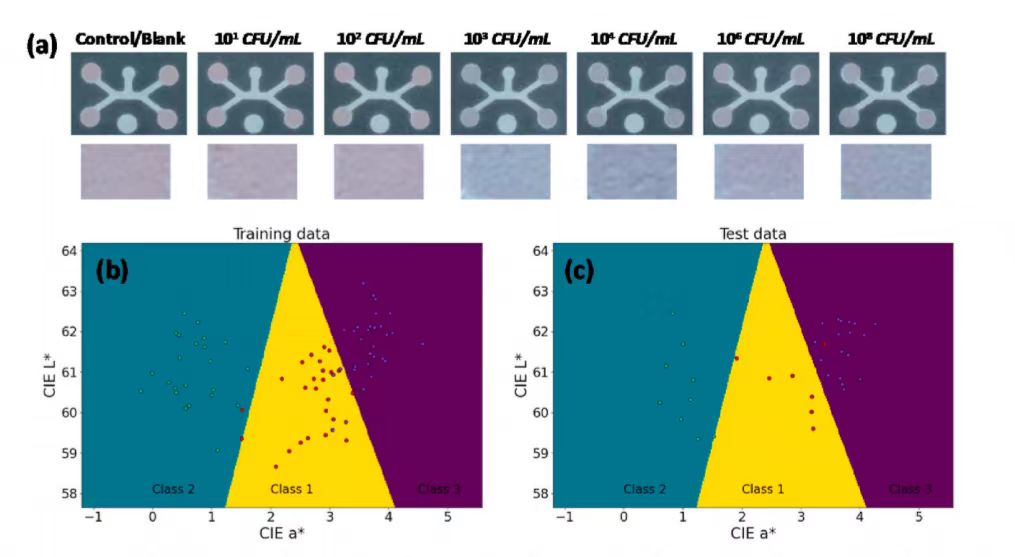
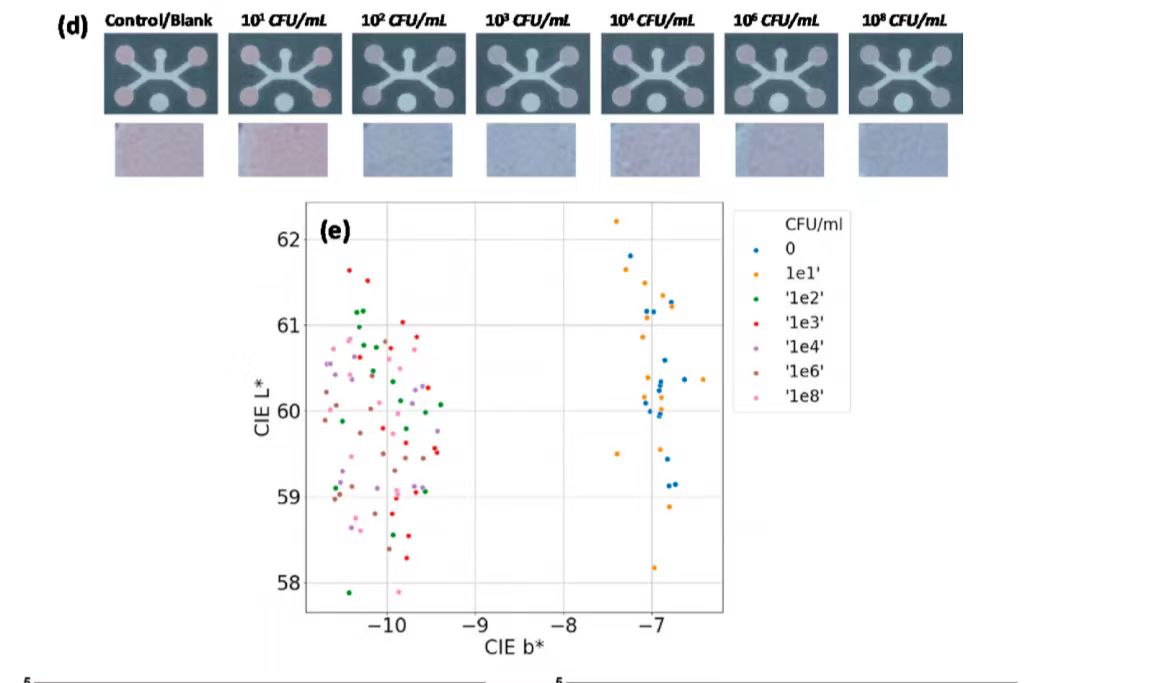
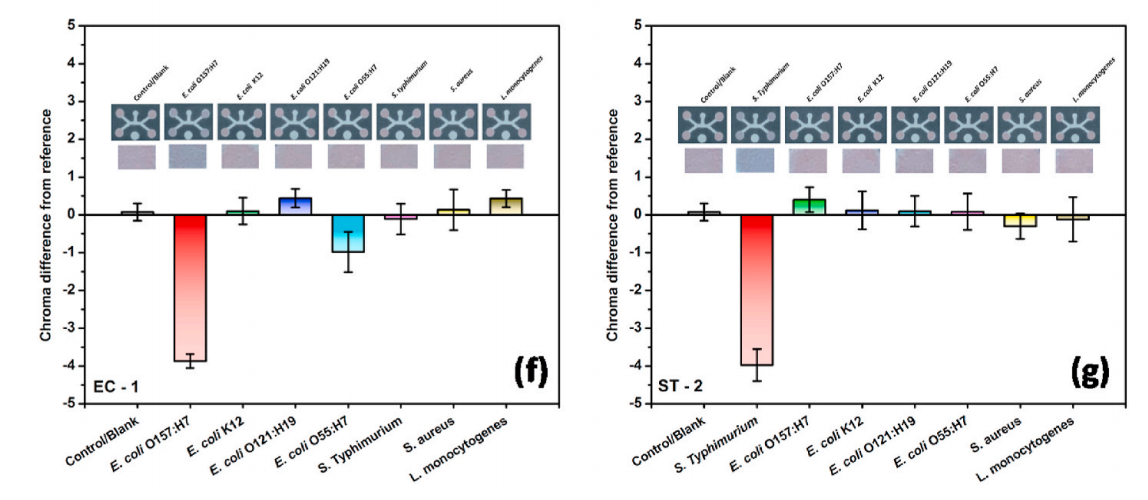 图 4(a)不同浓度大肠杆菌O157的纸基比色检测响应:H7 (b)训练数据集SVM分类器边界的确定 (c)试验数据的预测 (d)不同浓度鼠伤寒沙门氏菌的纸张比色响应 (e)所有数据点在CIE L*, b*颜色空间中的分布 (f)大肠杆菌O157:H7特异性适配体(EC -1)的纸张特异性测试和图像分析 (g)鼠伤寒沙门氏菌特异性适配体(ST-2)的纸张特异性测试和图像分析
图 4(a)不同浓度大肠杆菌O157的纸基比色检测响应:H7 (b)训练数据集SVM分类器边界的确定 (c)试验数据的预测 (d)不同浓度鼠伤寒沙门氏菌的纸张比色响应 (e)所有数据点在CIE L*, b*颜色空间中的分布 (f)大肠杆菌O157:H7特异性适配体(EC -1)的纸张特异性测试和图像分析 (g)鼠伤寒沙门氏菌特异性适配体(ST-2)的纸张特异性测试和图像分析通过评估非靶菌大肠杆菌K12、大肠杆菌O121:H19、大肠杆菌O55:H7、鼠伤寒沙门氏菌、金黄色葡萄球菌和单核增生李斯特菌的检测结果,考察适配体(EC-1)对大肠杆菌O157:H7的纸装置特异性。图4f的结果直观地显示了靶菌与非靶菌在测试区域的色度差异较大。因此,特异性结果证实了适体(EC-1)对目标大肠杆菌O157:H7具有高度特异性。从图4g可以看出,与其他非靶菌相比,鼠伤寒沙门氏菌反应的色度差值相对较大。因此,特异性结果证实了具有ST-2适体的微流控适体传感器对靶鼠伤寒沙门氏菌具有高度特异性。
利用微流控纸同时检测大肠杆菌O157: H7和鼠伤寒沙门氏菌,将大肠杆菌O157:H7和鼠伤寒沙门氏菌特异性的PS-Au-ssDNA-BSA微粒分别滴投在纸基装置的左侧和右侧两个通道上,进行多路检测。此外,将含有大肠杆菌O157:H7和鼠伤寒沙门氏菌的不同浓度的目标溶液滴投于纸装置的入口区域,并记录各自的比色响应。大肠杆菌O157:H7在103 ~ 108 CFU/mL浓度范围内比色信号变化显著。对于鼠伤寒沙门氏菌,在102 CFU/mL ~ 108 CFU/mL浓度范围内,比色信号发生变化。因此,所述多路复用设备的结果与所述单目标检测设备一致。

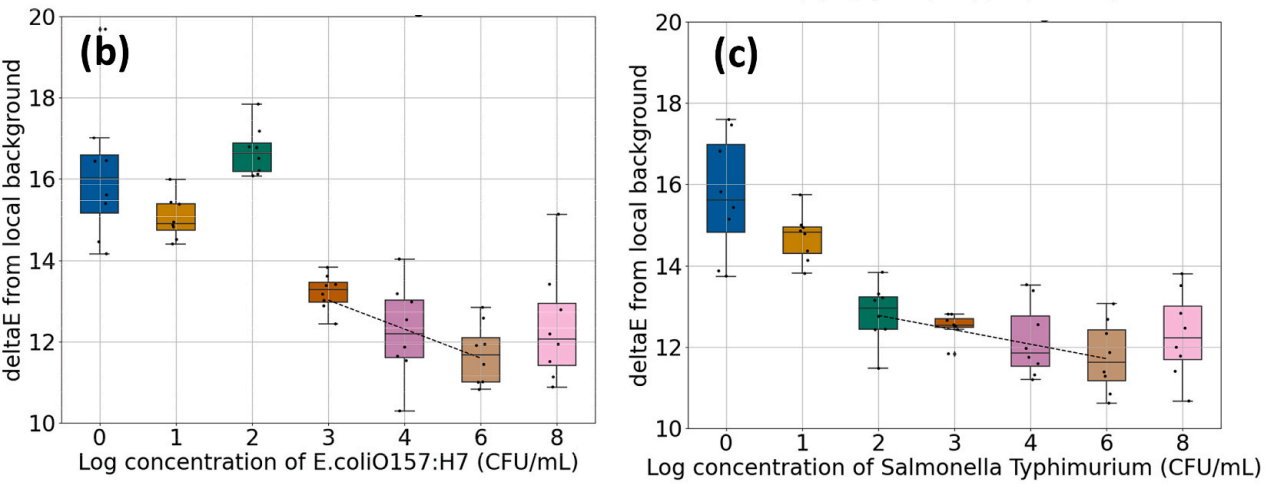

 图 5(a)不同浓度的大肠杆菌O157:H7和鼠伤寒沙门氏菌纸基复合检测 (b)不同浓度的大肠杆菌O157:H7多重检测试验中ΔE值的分布 (c)不同浓度的鼠伤寒沙门氏菌用纸复合检测试验中ΔE值的分布 (d)梨汁样品中不同浓度的大肠杆菌O157:H7纸基复合检测 (e)梨汁样品中不同浓度鼠伤寒沙门氏菌的纸基检测 (f)ΔE值与梨汁样品中大肠杆菌O157:H7浓度升高的相关性 (g)ΔE值与梨汁样品中鼠伤寒沙门氏菌浓度升高的相关性
图 5(a)不同浓度的大肠杆菌O157:H7和鼠伤寒沙门氏菌纸基复合检测 (b)不同浓度的大肠杆菌O157:H7多重检测试验中ΔE值的分布 (c)不同浓度的鼠伤寒沙门氏菌用纸复合检测试验中ΔE值的分布 (d)梨汁样品中不同浓度的大肠杆菌O157:H7纸基复合检测 (e)梨汁样品中不同浓度鼠伤寒沙门氏菌的纸基检测 (f)ΔE值与梨汁样品中大肠杆菌O157:H7浓度升高的相关性 (g)ΔE值与梨汁样品中鼠伤寒沙门氏菌浓度升高的相关性为了确定所提出的比色传感器在食品基质中的适用性,我们测试了微流控纸基装置对梨汁样品中存在的大肠杆菌O157:H7和鼠伤寒沙门氏菌的检测。图5d和e显示了纸基检测梨汁样品中大肠杆菌O157:H7和鼠伤寒沙门氏菌的比色响应。
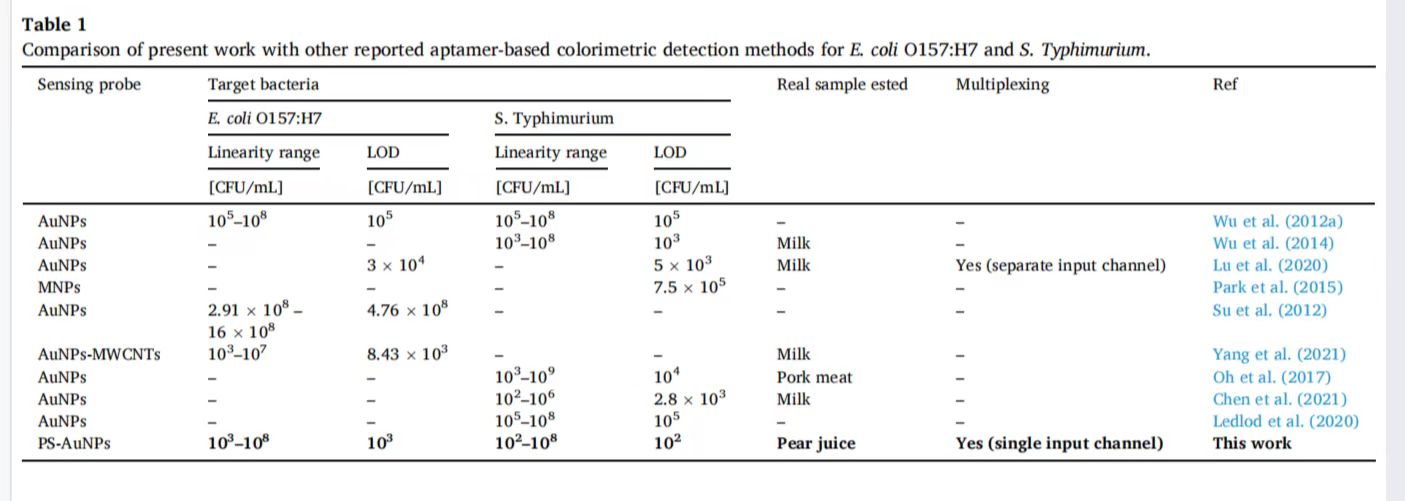
表 1此项设备与其他基于适配体的大肠杆菌O157:H7和鼠伤寒沙门氏菌比色检测方法的比较。
 该研究将AuNPs修饰在PS微粒子上,通过避免非特异性聚集和促进比色信号增强,增强了所提出的比色传感器的稳定性、灵敏度和选择性。此外,还设计了一种具有多重检测大肠杆菌O157:H7和鼠伤寒沙门氏菌的微流控纸装置,并利用图像分析将设备从仅仅提供定性阳性/阴性结果转化为通过颜色强度与目标浓度的相关性进行定量检测。
该研究将AuNPs修饰在PS微粒子上,通过避免非特异性聚集和促进比色信号增强,增强了所提出的比色传感器的稳定性、灵敏度和选择性。此外,还设计了一种具有多重检测大肠杆菌O157:H7和鼠伤寒沙门氏菌的微流控纸装置,并利用图像分析将设备从仅仅提供定性阳性/阴性结果转化为通过颜色强度与目标浓度的相关性进行定量检测。原始出处:Microfluidic paper-based aptasensor devices for multiplexed detection of pathogenic bacteria

